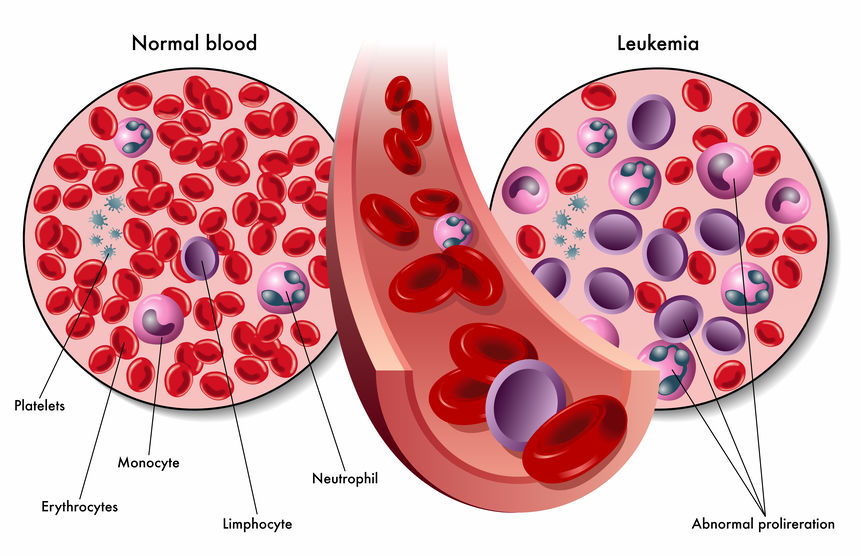
En la leucemia mieloide aguda (LMA), la transformación maligna y la proliferación no controlada de una célula progenitora mielocítica de diferenciación anormal y supervivencia prolongada determinan altos números de elementos sanguíneos inmaduros circulantes y reemplazo de la médula ósea normal por células malignas. Los síntomas son cansancio, palidez, propensión a hematomas y hemorragia, fiebre e infección; hay síntomas de infiltración leucémica extramedular sólo en alrededor del 5% de los pacientes (a menudo, manifestaciones cutáneas). El examen del frotis de sangre periférica y la médula ósea es diagnóstico. El tratamiento incluye quimioterapia de inducción para alcanzar la remisión y quimioterapia posremisión (con o sin trasplante de células madre) para evitar la recidiva.
La American Cancer Society estimó que en los Estados Unidos en 2023 se producirían alrededor de 20.000 casos nuevos de leucemia mieloide aguda (LMA) y 11.300 muertes, casi todas en adultos. La leucemia mieloide aguda es ligeramente más común en hombres que en mujeres, pero el riesgo promedio durante toda la vida en ambos sexos es de aproximadamente 0,5% (1 cada 200 estadounidenses).
La leucemia mieloide aguda comprende aproximadamente el 25% de las leucemias infantiles, que a menudo se desarrollan en la lactancia. Sin embargo, la incidencia de la leucemia mieloide aguda aumenta con la edad; es la leucemia aguda más frecuente en los adultos, con una mediana de edad de comienzo de 68 años. La leucemia mieloide aguda también puede aparecer como cáncer secundario después de la quimioterapia o la radioterapia por un tipo de cáncer diferente. La leucemia mieloide aguda secundaria es difícil de tratar con quimioterapia sola.
Fisiopatología de la leucemia mieloide aguda
En forma similar a la leucemia linfoblástica aguda, la leucemia mieloide aguda es causada por una serie de aberraciones genéticas adquiridas. Por lo general, la transformación maligna tiene lugar en el nivel de la célula madre pluripotente, aunque a veces afecta una célula madre especializada con capacidad de autorrenovación más limitada. La proliferación anormal, la expansión clonal, la diferenciación aberrante y la disminución de la apoptosis (muerte celular programada) determinan el reemplazo de los elementos normales de la sangre por células malignas.
Clasificación de la leucemia mieloide aguda
La leucemia mieloide aguda tiene varios subtipos y neoplasias precursoras que se distinguen entre sí por la morfología, el inmunofenotipo, la citoquímica y las anomalías genéticas (véase también Classification of myeloid neoplasms de la Organización Mundial de la Salud 2016, OMS) todo lo cual tiene implicaciones importantes para el pronóstico y el tratamiento. En el sistema de gradación de la OMS se describen siete clases que incluyen las siguientes
Leucemia mieloide aguda con anomalías genéticas recurrentes
Leucemia mieloide aguda con cambios relacionados con la mielodisplasia (LMA-CRM)
Leucemia mieloide aguda relacionada con la terapia (t-AML)
Leucemia mieloide aguda, no especificado de otra manera
Sarcoma mieloide
Proliferaciones mieloides relacionadas con el síndrome de Down
Neoplasia de células dendríticas plasmocitoides blásticas
Los criterios morfológicos del sistema de clasificación anterior French-American-British (FAB) se utilizan para subtipos que no se especifican de otro modo (NOS).
La leucemia promielocítica aguda (LPA) es un subtipo de leucemia mieloide aguda con anormalidades genéticas recurrentes. La leucemia promielocítica aguda es un subtipo de particular importancia, que representa del 10 al 15% de los casos de leucemia mieloide aguda y afecta a un grupo etario más joven (mediana de edad 31 años) y un grupo étnico particular (hispanos). Los pacientes suelen presentar un trastorno de la coagulación (p. ej., coagulación intravascular diseminada [CID]).
La leucemia mieloide aguda relacionada con la terapia (t-LMA) es un subtipo de leucemia mieloide aguda causado por el tratamiento previo con ciertos medicamentos antineoplásicos (p. ej., agentes alquilantes, hidroxiurea e inhibidores de la topoisomerasa II). La mayoría de los casos de t-LMA (leucemia mieloide aguda) ocurren entre 3 y 10 años después de la terapia inicial, con una latencia más larga para los agentes alquilantes e hidroxiurea (latencia media de 5 a 7 años) que para los inhibidores de la topoisomerasa II (latencia media de 6 meses a 3 años). Los agentes alquilantes causan deleciones cromosómicas y translocaciones desequilibradas. La hidroxiurea causa del(17)p y también inhibe la activación de TP53. Los inhibidores de la topoisomerasa II conducen a translocaciones cromosómicas equilibradas.
El sarcoma mieloide se caracteriza por infiltración mieloblástica extramedular de la piel (leucemia cutis), encías y otras superficies mucosas.
Signos y síntomas de la leucemia mieloide aguda
Por lo general, los síntomas de la leucemia mieloide aguda pueden estar presentes sólo días a semanas antes del diagnóstico. Los síntomas de presentación más comunes se deben a la hematopoyesis interrumpida con la consiguiente
Anemia
Trombocitopenia
Granulocitopenia
La anemia puede manifestarse con fatiga, debilidad, palidez, malestar general, disnea de esfuerzo, taquicardia y dolor torácico durante el esfuerzo.
La trombocitopenia puede causar sangrado de la mucosa, hematomas espotáneos, petequias/púrpura, epistaxis, sangrado de las encías y sangrado menstrual abundante. La hematuria y la hemorragia digestiva son infrecuentes. Los pacientes pueden presentar hemorragia espontánea, incluidos hematomas intracraneales o intraabdominales.
Granulocitopenia (neutropenia), que puede conducir a un alto riesgo de infecciones, incluidas las de etiologías bacterianas, micóticas y virales. Los pacientes pueden presentar fiebre y una infección grave y/o recurrente. A menudo, no se identifica la causa de la fiebre, aunque la granulocitopenia puede favorecer una infección bacteriana de progresión rápida y potencialmente fatal.
Leucemia cutis (localizada)
La leucemia cutis puede tener varias apariencias, como pápulas o nódulos y placas, y puede ser eritematosa, marrón, hemorrágica o violácea/gris azulada.
Leucemia cutis (diseminada)
Sin embargo, la infiltración de células leucémicas en otros sistemas de órganos tiende a ser menos común en la leucemia mieloide aguda que en la leucemia linfoblástica aguda:
El infiltrado puede aumentar el tamaño del híhado, el bazo y los ganglios linfáticos.
La infiltración de médula ósea y perióstica puede causar dolor óseo y articular.
La infiltración meníngea puede provocar parálisis de los nervios craneales, dolor de cabeza, síntomas visuales o auditivos, estado mental alterado y ataque isquémico transitorio/accidente cerebrovascular.
Diagnóstico de la leucemia mieloide aguda
Hemograma completo y frotis de sangre periférica
Examen de médula ósea
Estudios histoquímicos, citogenéticos, de inmunofenotipificación y de biología molecular
El diagnóstico de leucemia mieloide aguda se confirma cuando los blastos mieloides superan ≥ 20% de las células nucleadas de la médula ósea o ≥ 20% de células no tiroideas cuando el componente eritroide es > 50%, o con cualquier porcentaje de blastos en presencia de anormalidades citogenéticas recurrentes [t(8;21), t(15;17), inv(16) o t(16;16)]. El diagnóstico puede basarse en los mismos criterios que se usan en sangre periférica.
Blastocitos en sangre periférica
Los primeros análisis que se realizan son hemograma completo y frotis periférico; la pancitopenia y los blastocitos periféricos sugieren una leucemia aguda. En el frotis periférico, los blastocitos pueden acercarse al 90% del recuento de glóbulos blancos.
En el diagnóstico diferencial de pancitopenia grave, deben considerarse la anemia aplásica, las infecciones virales como la mononucleosis infecciosa, las deficiencias de vitamina B12 y de ácido fólico. Las reacciones leucemoides (leucocitosis granulocítica significativa [es decir, leucocitos > 50.000/mcL, > 50 × 109/L] producidos por la médula ósea normal) en respuesta a la enfermedad infecciosa nunca se manifiestan con recuentos elevados de blastos.
El examen de médula ósea (aspiración y biopsia con aguja) se realiza de forma rutinaria. Los blastos en la médula ósea suelen corresponder al 25 al 95% de las células en los pacientes con leucemia mieloide aguda.
Los estudios histoquímicos, citogenéticos, de inmunotipificación y de biología molecular ayudan a distinguir los blastocitos de la leucemia linfoblástica aguda de los de la leucemia mieloide aguda u otros procesos patológicos. Los estudios histoquímicos incluyen tinción de mieloperoxidasa, que es positiva en células de origen mieloide. La cristalización de los gránulos ricos en mieloperoxidasa conduce a la formación de bastones Auer (inclusiones azurófilas lineales en el citoplasma de las células blásticas), que son patognómicas de la leucemia mieloide aguda. La detección de marcadores inmunofenotípicos específicos (p. ej., CD13, CD33, CD34, CD117) es esencial para clasificar las leucemias agudas.
Las anomalías citogenéticas comúnmente observadas en la LMA incluyen t(15;17), trisomía 8, t(8;21), inv(16) o t(16;16) y reordenamientos 11q23.3 (véase tabla Anormalidades citogenéticas comunes en la leucemia mieloide aguda).
Anormalidades citogenéticas comunes en la leucemia mieloide aguda
Las anomalías citogenéticas menos frecuentes incluyen
t(9;11)(p22.3;q23.3)/MLLT3-KMT2A
t(1;22)(p13.3;q13.1)/RBM15-MKL1
t(6;9)(p23;q34.1)/DEK-NUP214
inv(3)(q21.3q26.2)
Otros hallazgos de laboratorio pueden consistir en hiperuricemia, hiperfosfatemia, hiperpotasemia, hipocalcemia y aumento de la láctico deshidrogenasa. Estos hallazgos indican un síndrome de lisis tumoral. También pueden estar presentes concentraciones séricas elevadas de transaminasas hepáticas y/o creatinina y seudohipoglucemia.
La TC de la cabeza se realiza en pacientes con síntomas del sistema nervioso central. La ecocardiografía o la exploración en multiventanas (MUGA) generalmente se realiza para evaluar la función cardíaca basal antes de administrar antraciclinas, que son cardiotóxicas.
Tratamiento de la leucemia mieloide aguda
Para pacientes médicamente aptos: quimioterapia (inducción y consolidación) con o sin trasplante alogénico de células madre hematopoyéticas
Para pacientes médicamente frágiles: terapias menos intensivas
Para todos: atención sintomática
El tratamiento de la leucemia mieloide aguda depende de la condición médica general del paciente. Los pacientes médicamente aptos tienden a ser más jóvenes y tienen anormalidades citogenéticas de menor riesgo, mejor estado funcional y menos comorbilidades que los pacientes médicamente frágiles.
Debido a que el tratamiento de la leucemia mieloide aguda es complejo y está evolucionando, es mejor hacerlo en el centro más especializado disponible, particularmente durante las fases críticas (p. ej., inducción de remisión); los ensayos clínicos son la primera opción cuando están disponibles.
Pacientes médicamente aptos con leucemia mieloide aguda
En pacientes médicamente aptos, el tratamiento inicial es la quimioterapia de inducción para tratar de inducir una remisión completa. Los pacientes en remisión se someten a una terapia de consolidación que puede incluir un trasplante alogénico de células madre hematopoyéticas.
La remisión completa se define como 5% de células blásticas en la médula ósea, recuento absoluto de neutrófilos > 1000/mcL (> 1 × 109/L), recuento de plaquetas > 100.000/mcL (> 100 × 109/L), y falta de necesidad de transfusión de sangre.
El esquema de inducción básico (conocido como 7+3) incluye citarabina mediante infusión IV continua o altas dosis durante 7 días; se administra daunorrubicina o idarrubicina por vía IV por 3 días durante este período. Por lo tanto, el tratamiento causa mielosupresión significativa, con infección o hemorragia. Hay latencia significativa antes de la recuperación de la médula. Durante este período, el tratamiento preventivo meticuloso y la terapia sintomática son fundamentales.
Las tasas de remisión completa con 7+3 son aproximadamente del 70 al 85% (genética favorable, véase Pronóstico de la leucemia mieloide aguda basado en algunas anormalidades citogenéticas comuness), del 60 al 75% (genética intermedia) y del 25 al 40% (genética adversa); las tasas de remisión completa también dependen de factores de riesgo de enfermedad específicos del paciente y de otro tipo (p. ej., leucemia mieloide aguda secundaria comparada con s de novo).$ Sin embargo, la mayoría de los pacientes que logran una remisión completa con 7+3 (u otro régimen de inducción convencional) finalmente recaen.
La reinducción generalmente se recomienda para pacientes con leucemia residual el día 14, aunque no hay evidencia de alta calidad de que mejore el resultado. La leucemia residual se define de forma variable como blastos en la médula ósea > 10% con celularidad de la médula ósea > 20%. Los diversos regímenes de reinducción recomendados incluyen diferentes dosis de citarabina. Algunos incluyen antraciclinas con o sin un tercer agente.
Se pueden usar varios medicamentos con la quimioterapia tradicional 7+3 o en lugar de ella. La adición de midostaurina, un inhibidor de la cinasa, a la quimioterapia parece prolongar la supervivencia en ciertos pacientes (p. ej., adultos < 60 años con diagnóstico reciente de leucemia mieloide aguda con mutación>FLT3) (1). Gemtuzumab ozogamicina (un conjugado de anticuerpo-fármaco dirigido contra CD33) se puede combinar con quimioterapia en pacientes con leucemia mieloide aguda CD33 positiva recién diagnosticada. Gemtuzumab ozogamicina también se usa a veces como monoterapia para inducción y consolidación.
En muchos regímenes se indica una fase de consolidación tras la remisión. Esto puede llevarse a cabo con los fármacos administrados para la inducción u otros. Los esquemas con citarabina en alta dosis pueden prolongar la duración de la remisión, en particular cuando se indican como tratamiento para la consolidación en pacientes < 60 años. para los pacientes con leucemia mieloide aguda no lpa con citogenética favorable en primera remisión completa, la consolidación con citarabina en dosis altas se considera la terapia estándar posterior .
La terapia de mantenimiento con una formulación oral de azacitidina se asoció con una supervivencia global significativamente más larga y una supervivencia sin recaídas en cmparación con el placebo entre los pacientes > 55 años que experimenaron una primera remisión después de la quimioterapia intensiva y no eran candidatos para el trasplante de células madre hematopoyéticas (2).
Se dispone de una combinación liposómica de daunorrubicina y citarabina para el tratamiento de adultos con leucemia mieloide aguda relacionada con el tratamiento (t-LMA) o leucemia mieloide aguda con cambios relacionados con mielodisplasia (LMA-CRM) recién diagnosticados. Esta combinación mostró superioridad en la supervivencia global en comparación con la terapia de referencia con citarabina más daunorrubicina (régimen 7+3) en pacientes de 60 a 75 años de edad con diagnóstico reciente de t-LMA o LMA-CRM (3).
El trasplante alogénico de células madre realizado durante la primera remisión completa generalmente puede mejorar el resultado en pacientes con citogenética de riesgo intermedio o adverso. En general, se necesitan de 6 a 12 semanas para prepararse para el trasplante de células madre. Las recomendaciones consisten en continuar con la quimioterapia de consolidación convencional con citarabina en dosis altas mientras se espera el trasplante de células madre definitivo. Las afecciones que pueden hacer que los pacientes no sean elegibles para el trasplante alogénico de células madre incluyen un estado general deficiente y un deterioro moderado a grave de la función pulmonar, hepática, renal o cardíaca.
En la LPA y otros casos de leucemia mieloide aguda, puede haber coagulación intravascular diseminada (CID) cuando se diagnostica la leucemia y puede agravarse a medida que la lisis de las células leucémicas libera químicos procoagulantes. En la LPA con la translocación t(15;17), el ácido todo-trans-retinoico (tretinoína) corrige la coagulación intravascular diseminada en 2-5 días; en combinación con daunorrubiciina o idarrubicina, este esquema puede inducir remisión en el 80-90% de los pacientes y permitir supervivencia prolongada en el 65-70%. El trióxido de arsénico también es muy activo en la LPA. La terapia dirigida con tretinoína y trióxido de arsénico sin quimioterapia citotóxica convencional se tolera muy bien y ha sido extremadamente exitosa en la LPA con una tasa de remisión completa del 100% y una tasa de curación > 90% (4).
Pacientes médicamente frágiles con leucemia mieloide aguda
En pacientes mayores y médicamente frágiles, la terapia inicial suele ser menos intensiva.
Debido a que la mediana de edad para el diagnóstico de la leucemia mieloide aguda es de 68 años, la mayoría de los pacientes con diagnóstico reciente en general son ancianos. Los pacientes de edad avanzada tienen más probabilidades de tener comorbilidades que limitan sus opciones terapéuticas. Los pacientes de edad avanzada también tienen muchas más probabilidades de tener anormalidades citogenéticas de alto riesgo (p. ej., cariotipo complejo, monosomía 7), leucemia mieloide aguda secundaria derivada de un síndrome mielodisplásico o neoplasias mieloproliferativas o leucemia mieloide aguda con resistencia a múltiples fármacos.
Aunque la quimioterapia intensiva no se utiliza en pacientes mayores, mejora la tasa de remisión completa y la supervivencia global en pacientes < 80 años, particularmente en aquellos con cariotipos de riesgo favorable. lograr una remisión completa también mejora la calidad de vida al reducir las hospitalizaciones, las infecciones y los requisitos de>
Los inhibidores de la DNA metiltransferasa decitabina y azacitidina son análogos de nucleósidos pirimidinas que modulan el DNA al reducir la metilación de la región promotora de los genes supresores de tumores. Han mejorado los resultados clínicos en pacientes de edad avanzada con leucemia mieloide aguda de novo, así como en aquellos con s-LMA (leucemia mieloide aguda precedida por síndrome mielodisplásico), t-LMA (leucemia mieloide aguda relacionada con la terapia) y LMA que alberga mutaciones TP53. Uno de estos medicamentos puede administrarse solo como tratamiento de primera línea en muchos pacientes mayores, particularmente aquellos con un estado funcional/de desempeño comprometido, disfunción orgánica o biología tumoral (p. ej., cariotipo, aberraciones moleculares) que predice una respuesta deficiente a la quimioterapia intensiva.
Venetoclax, un inhibidor de la proteína anti-apoptósica BCL-2, se usa en combinación con azacitidina, decitabina o citarabina en dosis bajas para el tratamiento de la leucemia mieloide aguda recién diagnosticada en adultos ≥ 75 años, o que tienen comorbilidades que impiden el uso de quimioterapia de inducción intensiva. En un estudio de fase 3, los pacientes con LMA confirmada no tratados previamente que no eran candidatos para la terapia de inducción estándar fueron aleatorizados para recibir azacitidina más venetoclax.

Publicar un comentario